诺华(NVS.US)BCR-ABL变构抑制剂国内获批新临床
发布于: 2023-10-13 08:30
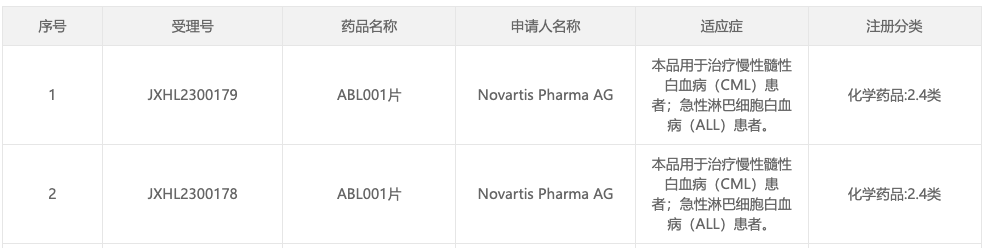
查投资获悉,10月12日,据 CDE 官网显示,诺华(NVS.US)递交的 BCR-ABL 变构抑制剂 Asciminib 新临床试验申请获默示许可(受理号:JXHL2300178),用于治疗慢性髓性白血病(CML)患者;急性淋巴细胞白血病(ALL)患者。
据了解,Asciminib 于 2021 年10月获 FDA 加速批准上市,用于既往接受至少两种 TKI 治疗的费城染色体阳性 CML 慢性期(Ph+ CML-CP)成人患者,并完全获批用于 T315I 突变型 Ph+ CML-CP 成人患者。此后,又分别于 2022 年 3 月、8 月,在日本、欧盟获批上市。
在国内,于 2021 年 3 月首次启动临床,针对慢性髓系白血病,目前正在开展 4 项临床试验,包括一项 10 月 4 日在ClincalTrials.gov 平台上登记启动的 I/II 期临床试验(登记号:NCT04925479),目前暂未在 CDE 临床试验平台登记启动。其中,III 期临床试验(登记号:NCT04971226)当前已完成所有受试者的招募工作,该研究旨在对比 Asciminib 和 TKI 疗法用于新确诊的 Ph+ CML-CP 患者的临床疗效。